Karakterisatie van mesenchymale stamcellen
De laatste jaren is het gebruik van mesenchymale stamcellen (MSC) voor klinische toepassingen in de diergeneeskunde enorm toegenomen. Aanvankelijk werden de isolatie en karakterisatie van equine MSC op een weinig gestandardiseerde manier uitgevoerd, hetgeen in schril contrast stond met de gedetailleerde richtlijnen die reeds eerder beschreven waren voor de éénduidige karakterisatie van humane MSC. In een eerste studie werd het protocol om MSC te isoleren uit navelstrengbloed geoptimaliseerd waarbij vier isolatiemethodes werden vergeleken (hydroxyethylzetmeel, ammoniumchloride, Ficoll-Paque en Percoll) alsook verschillende cultuurcondities zoals de celconcentratie, het cultuurmedium en het al dan niet vooraf coaten met foetaal kalf serum (Figuur 1).
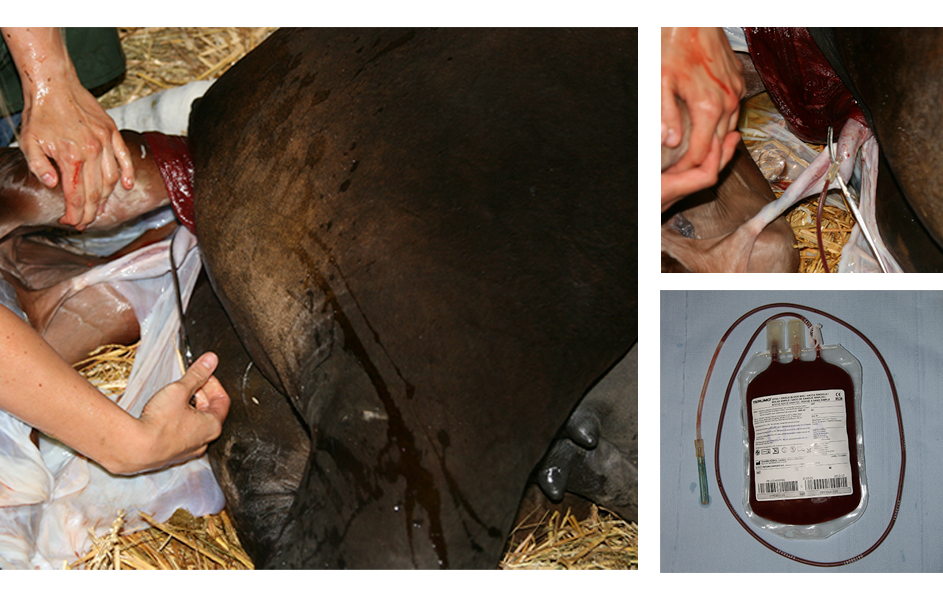
Figuur 1. Een grote hoeveelheid navelstrengbloed kan op een niet-invasieve manier verzameld worden tijdens de partus zonder merrie of veulen nadeel te berokkenen.
Om de mesenchymale stamcelidentiteit van de geïsoleerde cellen te bevestigen, werden de cellen na isolatie gedifferentieerd naar de osteogene, chondrogene en adipogene cellijn (Figuur 2). Daarnaast werden ze ook gefenotypeerd door de expressie van verschillende eiwitmerkers na te gaan met behulp van multicolor flowcytometrie.
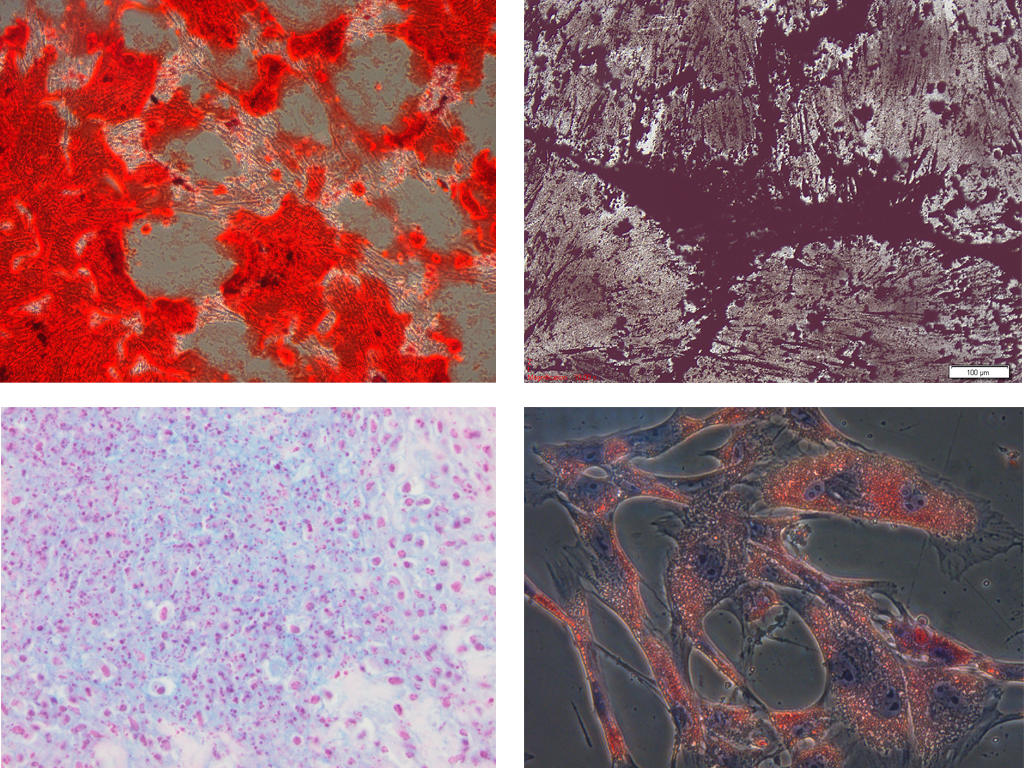
Figuur 2. Differentiatiecapaciteit van equine mesenchymale stamcellen: (1) osteogene differentiatie aangetoond met behulp van Alizarine Red S en (2) Von Kossa kleuring, (3) chondrogene differentiatie aangetoond met behulp van Alcian Blue kleuring en (4) adipogene differentiatie aangetoond met behulp van Oil Red O kleuring (De Schauwer et al., 2011).
Aangezien sommige eiwitten, die kenmerkend zijn voor MSC, ook voorkomen op endotheel-, epitheel- en spiercellen, was een panel van verschillende merkers nodig om op een éénduidige manier MSC te identificeren. Zodoende dienen humane MSC de merkers CD29, CD44, CD73, CD90 en CD105 tot expressie te brengen terwijl CD14, CD34, CD45, CD79α en MHC II afwezig moeten zijn. Er zijn echter maar weinig monoclonale antilichamen beschikbaar om MSC van grote en kleine huisdieren op een analoge manier te fenotyperen. Daarom werd bij 30 commercieel beschikbare monoclonale antilichamen nagegaan of ze equine epitopen herkennen waarbij equine mononucleaire cellen, equine lymfocyten of equine endotheelcellen als positieve controlegroepen gebruikt werden (Figuur 3). Vervolgens werd een multicolor flowcytometrisch protocol opgesteld om equine MSC te fenotyperen waarbij zowel de aanwezigheid van bepaalde eiwitten typisch voor MSC als de afwezigheid van eiwitten kenmerkend voor hematopoietische cellen, terzelfdertijd kon worden aangetoond.
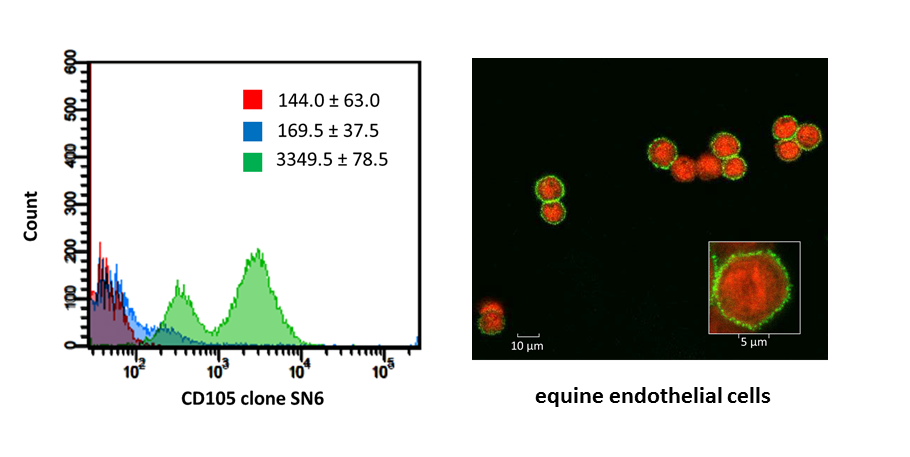
Figuur 3. De kruisreactiviteit van monoclonale antilichamen om equine epitopen te identificeren, werd geëvalueerd met behulp van flowcytometrie en confocale fluorescentie microscopie (De Schauwer et al., 2012).
Als algemeen besluit kan gelden dat equine MSC voor het eerst volledig gefenotypeerd werden.
Daarenboven werd de isolatie van equine MSC uit andere bronnen zoals beenmerg, vetweefsel, perifeer bloed en navelstrengmatrix geoptimaliseerd, en hebben we ook ervaring met andere diersoorten zoals hond en rund.
